|
ฮาเบอร์โปรเฟส
ฮาเบอร์โปรเฟสเป็นการผลิตแอมโมเนีย แอมโมเนียมจะถูกผลิตขึ้นโดย กระบวนการฮาเบอร์
วัตถุดิบเช่น อย่างไนโตรเจน ในอากาศและ ไฮโดรเจน ซึ่งจะได้จากก๊าซธรรมชาติหรือมีเทน
| มีเทน |
+ |
ไอน้ำ |
—› |
ไฮโดรเจน
|
+ |
คาร์บอนไดออกไซด์ |
| CH4 (g) |
+ |
2H2O (g) |
—› |
4H2 (g) |
+ |
CO2 (g) |
ปฏิกริยาย้อนกลับสร้างแอมโมเนีย
| |
ไนโตรเจน |
+ |
ไฮโดรเจน |
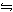 |
แอมโมเนีย |
| |
N2(g) |
+ |
3H2(g) |
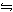 |
2NH3(g) |
สัญลักษณ์ 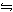 ลูกศรไปกลับหมายถึง ปฏิกิริยาที่สามารถย้อนกลับได้ซึ่งสามารถเป็นไปได้ทั้ง 2 ทิศทาง แอมโมเนียที่ได้นี้สามารถถูกทำให้เปลี่ยนกลับเป็นไฮโดรเจนและไนโตรเจนได้อีกครั้งหนึ่งในทันที ลูกศรไปกลับหมายถึง ปฏิกิริยาที่สามารถย้อนกลับได้ซึ่งสามารถเป็นไปได้ทั้ง 2 ทิศทาง แอมโมเนียที่ได้นี้สามารถถูกทำให้เปลี่ยนกลับเป็นไฮโดรเจนและไนโตรเจนได้อีกครั้งหนึ่งในทันที
เมื่ออัตราการเกิดปฏิกิริยามีค่าเท่ากับปฏิกิริยาย้อนกลับก็จะเกิด
ดุลยภาพ ในทุกๆ 2 โมเลกุลของแอมโมเนียที่เกิดจะมีอีก 2 โมเลกุลแตกตัว
หากต้องการผลิตแอมโมเนียจำนวนมากขึ้น เงื่อนไขของปฏิกิริยาต้องเปลี่ยนดุลยภาพไปทางขวา ทั้งนี้ อาจจำเป็นต้องเพิ่มอัตราของปฏิกิริยาให้เพิ่มขึ้น
|