| |
มวลอะตอมสัมพัทธ์ | มวลสูตรสัมพัทธ์ | ร้อยละขององค์ประกอบของสารประกอบ | การคำนวนมวลของตัวทำปฏิกิริยาหรือผลิตภัณฑ์ที่ได้
การคำนวนจากสูตร | วิธีคำนวนการแยกของเหลวด้วยไฟฟ้า |
| |
|
มวลอะตอมสัมพัทธ์
อะตอม ของธาตุที่แตกต่างกันจะมีมวลที่แตกต่างกัน
นักเคมีจำเป็นต้องรู้ว่าสารเคมีจำนวนเท่าใดที่ใช้ในการก่อให้เกิดปฏิกิริยา
อะตอม , อีออนและ โมเลกุลมีขนาดเล็กเกินไปที่จะนับหรือชั่งน้ำหนักได้ดังนั้นมวลเฉลี่ยของอะตอม ที่มีจำนวนมากของธาตุจึงถูกใช้ จำนวนของอะตอมเรียกกันว่า โมล และมวลของโมลเรียกเป็น มวลอะตอมสัมพัทธ์ หรือ , Ar ค่านี้โดยปกติแล้วใน ตารางธาตุ จะถูกเขียนไว้เหนือตัวอักษรของธาตุนั้น ๆ เช่นสำหรับคาร์บอน 426 ค่ามวลอะตอมสัมพัทธ์คือ 12
สำหรับคาร์บอน 12C , มีค่ามวลอะตอมสัมพัทธ์เป็น 12
6
ความสัมพัทธ์ของค่ามวลอะตอมของธาตุบางธาตุ
|
Element
|
Symbol
|
Ar
|
Element
|
Symbol
|
Ar
|
|
Hydrogen
|
H
|
1
|
Magnesium
|
Mg
|
24
|
|
Carbon
|
C
|
12
|
Sulphur
|
S
|
32
|
|
Oxygen
|
O
|
16
|
Copper
|
Cu
|
64
|
|
|
มวลสูตรสัมพัทธ์
โดยใช้ค่าAr สามารถหามวลสูตรสัมพันธ์ M r ใน โมเลกุล
สูตรของน้ำคือ H2O
โมเลกุลของน้ำจะประกอบไปด้วย อะตอมไฮโดรเจน 2 ตะและอะตอมออกซิเจน 1 ตัว
มวลอะตอมสัมพัทธ์ของน้ำมีค่าเท่ากับ = 1+1+16
= 18
นี่คือตัวอย่างเพิ่มเติม
|
Compound
|
Formula
|
Number of atoms
|
Ar of atoms
|
Mr of compound
|
|
Magnesium oxide
|
MgO
|
1 Mg
1O
|
Mg = 24
O = 16
|
24 + 16
= 40
|
|
Sulphur dioxide
|
SO2
|
1 S
2 O
|
S = 32O
= 16
|
32 + 16
= 48
|
|
Copper carbonate
|
CuCO3
|
1 Cu
1C
3O
|
Cu = 64C
= 12O
= 16
|
64 + 12 + (3 x 16)
= 124
|
|
|
ร้อยละขององค์ประกอบของสารประกอบ
จากสูตรของสารประกอบสามารถหาเปอร์เซ็นต์ของธาตุได้ ถ้ารู้ค่ามวลสัมพัทธ์ของแต่ละธาตุ
สูตรของมีเทนคือ CH4
ค่ามวลสูตรสัมพัทธ์จะมีค่าเท่ากับ 12 + 1 + 1 + 1 + 1 = 16
|
เปอร์เซ็นต์ของคาร์บอนในมีเทน = มวลของคาร์บอนในมีเทน x 100
|
|
มวลทั้งหมด
|
|
|
เปอร์เซ็นต์ของไฮโดรเจนในมีเทน = มวลอของไฮโดรเจนในมีเทน x 100
|
|
มวลทั้งหมด
|
|
|
การคำนวนมวลของตัวทำปฏิกิริยาหรือผลิตภัณฑ์ที่ได้
จากสมการที่สมดุลย์ทำให้สามารถคำนวนหาปริมาณของสารเคมีที่เกี่ยวข้องได้
|
CaCO3(s)
|
+
|
2HCl(aq)
|
—>
|
CaCl2(aq)
|
+
|
CO2(g)
|
+
|
H2O(l)
|
|
|
|
|
|
|
|
|
|
|
|
Mr:
|
40+12+(3x16)
|
|
(2x1)+(2x35.5)
|
|
40+(2x35.5)
|
|
12+(2x16)
|
|
(2x1)+16
|
|
= 100
|
|
= 73
|
|
= 111
|
|
= 44
|
|
= 18
|
มวลของตัวทำปฏิกิริยาต้องเท่ากับมวลของผลิตภัณฑ์ที่ได้
เช่น การคำนวณหามวลคาร์บอนไดออกไซด์ เมื่อใช้แคลเซียมคาร์บอเนต 80 กรัม ทำปฏิกิริยากรดเกลือจำนวนมากกว่า
แคลเซียมคาร์บอเนต 100 กรัมจะผลิตคาร์บอนไดออกไซด์ 44 กรัม
ดังนั้น แคลเซียมคาร์บอเนต 1 กรัมจะผลิตคาร์บอนไดออกไซด์ 44/100 กรัม
|
แคลเซียมคาร์บอเนต 80 กรัมจะผลิต 80 x
|
44 คาร์บอนไดออกไซด์ |
| |
|
100 |
| |
| |
|
= 35.2 g |
บางครั้ง อาจต้องคำนวนจากก๊าซที่ได้จากปฏิกิริยา
มวลสัมพัทธ์ของก๊าซทุกชนิดจะมีปริมาณ 24 ลิตร ที่ 25 องศาเซลเซียสและ 1 แรงดันของบรรยากาศ
ดังนั้น ในการคำนวนปริมาณของคาร์บอนไดออกไซด์ในปฏิกิริยานี้คือ
| CO2 จำนวน 44 กรัม มีปริมาณ 24 ลิตร |
|
| ดังนั้น CO 2 1 กรัมจะมีค่า24 ลิตร |
|
44
|
|
| CO2 35.2 กรัม จะมีปริมาณ |
|
24 x 35.2 |
|
| |
|
44 |
|
|
=
|
|
19.2 ลิตร |
|
|
|
การคำนวนจากสูตร
สูตรของสารประกอบจะหาได้จากมวลหรือเปอร์เซนต์เฉลี่ยของสารเคมีที่ทำปฏิกิริยาที่รู้
เช่น สูตรของแม็กนีเซียมออกไซด์จะหาได้จากค่าที่ทราบของมวลแม็กนีเซียมที่เผาในเตาและน้ำหนักของแม็กนีเซียมออกไซด์ที่ได้
|
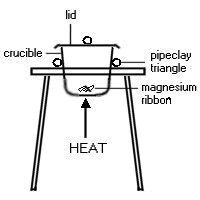 |
|
ตัวอย่างผลที่ได้
|
มวลเตา+ฝาปิด
|
= 20.2 g
|
|
มวลเตา+ฝาปิด+แม็กนีเซียม
|
= 22.6 g
|
|
มวลเตา+ฝาปิด+แม้กนีเซียมออกไซด์
|
= 24.2 g
|
|
มวลแม็กนีเซียมที่ถูกเผาไหม้
|
= 22.6 – 20.2 = 2.4 g
|
|
มวลของแม็กนีเวียมออกไซด์ที่ได้
|
= 24.2 – 20.2 = 4.0 g
|
|
ดังนั้น มวลของออกซิเจน
|
= 4.0 – 2.4 = 1.6 g
|
แม็กนีเซียม 2.4 กรัมรวมกับ ออกซิเจน 1.6 กรัม
จำนวนโมลของธาตุแต่ละชนิดหาได้จาก
|
จำนวนโมล
|
=
|
มวล
|
|
|
|
มวลของ 1 โมล( Ar)
|
|
|
Ar แม็กนีเซียม = 24
|
A r ออกซิเจน = 16
|
|
2.4
|
แม็กนีเซียมที่มีปฏิกิริยากับ 1.6 ออกซิเจน
|
| 24 |
|
16 |
แม็กนีเซียม 0.1 โมลทำปฏิกิริยากับออกซิเจน 0.1 โมล
ดังนั้น สูตรเคมีของแม็กนีเซียมออกไซด์คือ MgO เนื่องจากธาตุแต่ละชนิดใช้จำนวนโมลเท่ากัน
ไฮโดรเจน 1 กรัมทำปฏิกิริยากับกำมะถัน 1.6 กรัม ได้เป็นไฮโดรเจนซัลไฟด์
|
Ar ไฮโดรเจน = 1
|
Ar ซัลไฟด์ = 32
|
|
1 โมล ไฮรโดรเจนที่มีปฎิกิริยากับ 1.6 โมลของซัลไฟด์
|
|
1
|
32
|
ไฮโดรเจน 1 โมลทำปฏิกิริยากับกำมะถัน 0.5 โมล
สูตรเคมีของไฮโดรเจนซัลไฟด์คือ H2S
|
วิธีคำนวนการแยกของเหลวด้วยไฟฟ้า
หากเราทราบครึ่งปฏิกิริยาและมวลของผลิตภัณฑ์ที่ได้จากการแยกของเหลวด้วยไฟฟ้า จะสามารถมวลของสารที่อยู่อีกขั้วหนึ่งได้
เช่น จากครึ่งปฏิกิริยาจากการแยกของเหลวด้วยไฟฟ้าของน้ำเกลือ
|
2Cl-
|
- 2e-
|
—»
|
Cl2 |
|
2H+
|
- 2e-
|
—»
|
H2 |
หากทราบว่าไฮโดรเจนที่ได้ที 10 กรัม จะสามารถคำนวนหามวลของโซเดียมได้
|
จำนวนโมล =
|
มวล |
| |
มวลของ 1 โมล
|
Arไฮโดรเจน = 1, so Mr H2 = 2
Ar คลอรีน = 35.5, so Mr Cl2 = 71
| จำนวน โมลของไฮโดรเจน = |
10
|
= 5 |
| |
2
|
|
จำนวนโมลของไฮโดรเจนและคลอไรด์จะเกิดขึ้นเท่าๆ กัน
|
|
5 =
|
มวลของคลอรีน
|
|
|
|
71
|
|
| |
|
มวลของคลอรีน = 5 x 71
|
|
|
| |
= |
355g |
|
|
|