| การวัดอัตราของปฏิกิริยา
ปฏิกิริยาที่แตกต่างกันก่อให้เกิดความเร็วที่ต่างกันจะมีความเร็วที่แตกต่างกัน
การเกิดสนิมจะเป็นปฏิกิริยาที่เกิดขึ้นช้าในขณะที่การระเบิดจะเป็นปฏิกิริยาที่เกิดขึ้นเร็ว
ปฏิกิริยาเคมีสามารถวัดได้โดยการเกิดของผลิตภัณฑ์หรืออัตราการตั้งต้นของสารที่ใช้ไป
เมื่อสารละลายไซโอโซเดียมซัลเฟรตมีปฏิกิริยากับกรดเกลือจะได้ผลิตภัณฑ์คือกำมะถันที่จะมีลักษณะเป็นสีเหลืองสดใสและทำให้สารละลายที่ได้มีลักษณะขุ่น
อัตราของปฏิกิริยานี้สามารถวัดได้โดยระยะเวลาที่ใช้ในการที่กำมะถันก่อตัวดังนั้นการวางกระดาษที่มีกากบาทตรงที่พื้นของขวดแก้วก็จะช่วยปฏิกิริยาจนกระทั่งมองไม่เห็นกากบาทนั้น
.gif)
วิธีการนี้จะวัดที่จุดสิ้นสุดของปฏิกิริยา ถ้าปฏิกิริยาจะก่อให้เกิดแก๊สปริมาณของผลผลิตจะถูกวัดโดยระยะเวลาที่เกิดในหลอดทดลองดังนั้นกระบวนการที่เกิดขึ้นจึงสามารถถูกติดตามได้
แผนภูมิแสดงให้เห็นผลที่สามาถพอร์ดเป็นกราฟได้
ตัวอย่าง แมกนีเซียม+กรดเกลือ .GIF) แมกนีเซียมครอไรด์+ไฮโดรเจน แมกนีเซียมครอไรด์+ไฮโดรเจน
.gif) 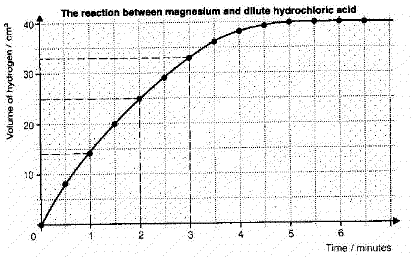
อัตราที่เกิดขึ้นจะเร็วในเบื้องต้นเนื่องจากมีส่วนที่ก่อให้เกิดปฏิกิริยาเหลืออยู่มาก
อัตราที่เกิดขึ้นในนาทีแรกคือ 14 ลูกบาศก์เซนติเมตร/นาที ปฏิกิริยายิ่งรวดเร็ว กราฟยิ่งรวดเร็วมาก
เมื่อปฏิกิริยาสิ้นสุดลงกราฟก็จะเป็นแนวราบไม่มีก๊าซถูกผลิตขึ้นอีกเนื่องจากสารตั้งต้นถูกใช้หมด
รูปแบบเดียวกันนี้ใช้ในการวัดการสุญเสียของมวลของแก๊สที่หลุดออกไปในท่อในเวลาที่ใช้กราฟของมวลที่หายไปก็จะถูกพอร์ดขึ้นมา
|